넙치(Paralichthys olivaceus)조직에서 lincomycin의 약동학 분석을 위한 액체크로마토그래피-질량분석법 개발
Abstract
Lincomycin is a drug known to be effective in treating streptococcus aureus as it inhibits the protein synthesis by binding to 50S ribosomal subunits. However, in the test method registered in Korean Food Code the Maximum Residue Limit (MRL) is set to be 0.1 mg/kg regardless of the kinds or body areas of fishes. In addition, only analysis using high performance liquid chromatography mass spectrometry (HPLC-MS/MS) was presented, so we developed analytical methods to detect trace concentrations of serum and muscle in the olive flounder using HPLC-MS/MS. The analyte was quantified in the positive ion mode using multiple reaction monitoring (MRM). Samples were extracted with methanol and then Hydrphilic-Liphophilic Balance (HLB) was used for purification. Matrix-matched calibration (MMC) presented linearity with the correlation coefficient (r²)>0.99, analyzed at 0.5~50 ng/g concentration. The limit of quantitation (LOQ) of muscle was 0.5 ng/g and recovery was 89.33%(n=9, Intra-day). The LOQ of serum was 0.5 ng/g and recovery was 97.40%(n=9, Intra-day) which were suitable for CODEX guideline. This analysis would be appropriate for the study of lincomycin residues and pharmacokinetics in olive flounder.
Keywords:
HPLC-MS/MS, Lincomycin, Olive flounder, PharmacokineticsⅠ. 서 론
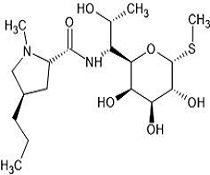
린코마이신(Lincomycin)은 Streptomyces lincolnensis에서 분리된 항생물질로서 세균의 50S ribosomal subunit에 결합하여 단백질 합성을 저해하는 정균제이다(Lin et al., 1997; Pyörälä et al., 2014). 국내에서 린코마이신은 염산염 형태로 소, 돼지 및 닭 등 각종 세균성 호흡기 질병의 치료를 위해 동물(축산)용의약품으로 널리 사용되고 있다(Collignon, 2008; Papich and Riviere, 2009). 그러나 어류에 사용되는 수산용의약품으로는 인·허가 사항이 없으며, 수의사의 처방 등으로 수산동물에 대한 축산용의약품의 특례처방이 가능한 상황이다. 따라서 수산 전용으로 사용가능 한 의약품 개발이 절실히 필요하다.
우리나라에서 생산되는 양식어류 중 넙치는 산업적으로 가장 중요한 품종이며(NIFS, 2016), 현재 다양한 항생제가 넙치에 허가되어 사용 및 관리되고 있다(NFQS, 2020). 특히 넙치는 다른 양식품종에 비해 침착하며 근육주사가 가능한 체형으로서 다양한 수산용 주사 항생제가 허가되어 있다(Lim et al., 2017; Lee et al., 2021). Kim et al.(2019)에 의하면 넙치에서 분리된 Streptococcus parauberis 임상 균주에 대한 린코마이신의 민감한 in vitro 상의 최소억제농도(Minimum inhibitory concentration, MIC)를 보고하여 넙치의 신규 주사용 항생제 개발 가능성을 보고하였다.
수산용의약품은 「약사법」 제85조 동물용 의약품 등에 대한 특례에 따라 국립수산물품질관리원에서 안전성 및 유효성 자료를 기반으로 인허가 하고 있다. 식용동물에게 사용되는 항생제는 식품위생학적으로 인체 안전성을 도모하기 위해 식품의약품안전처에서 잔류허용기준(Maximum residue limit, MRL)을 법적으로 정하고 있으며, 기준 준수여부 확인을 위해 표준화된 잔류분석법을 식품공전에 등재하여 관리하고 있다(KFDA, 2021). 린코마이신에 대한 국내 MRL은 축산동물에서 다양한 조직의 개별 기준으로 관리되고 있으며(<Table 1> 참조) 어류는 어종 또는 조직에 따른 구분 없이 0.1 mg/kg으로 설정되어 있다(KFDA, 2021). 식품공전에는 이미 축·수산물에 대한 린코마이신 분석법이 제시되어 있지만 어종별 매트릭스(Matrix)가 고려되지 않아 넙치 근육에서 정밀한 분석이 가능한지에 대한 연구가 필요한 실정이다. 또한 분석대상 매트릭스가 가식부위에 한정되어 있어 약동학 분석에 활용 가능한 혈액 정밀분석법은 부재하다.
현재 넙치에서 가장 사용빈도가 높은 수산용 주사 항생제는 β-lactam 계열의 아목시실린으로서, 13년도에 최초 허가된 후 수산질병관리사의 처방으로 사용되고 있지만(NFQS, 2020), 단일 계열의 약물을 지속적으로 사용함에 따라 β-lactam 내성균의 증가로 약품 효능 저하 등의 문제가 발생할 수 있다. 따라서 비 β-lactam 계열의 약물 개발이 필요하다고 판단되며, 넙치에 대한 안전 용법·용량 연구에 필수적인 혈액 약동학 및 식품 내 약품 잔류방지를 위한 근육 중 휴약기간 연구가 선행되어야 한다. 하지만, 넙치에서 근육 및 혈액 중 린코마이신의 정밀 잔류분석법에 대한 연구는 부재한 상황이며, 어류에 대한 약동학적 잔류 모델 적용이 가능한 고감도 정밀분석법의 개발이 필요하다.
따라서 본 연구에서는 식품공전의 시험법 등을 참고하여 HPLC-MS/MS를 활용한 넙치 근육 및 혈액에서의 고감도 분석법을 개발하고 어류 모델에서 적용 가능한 수준인지를 조사하였다.
Ⅱ. 재료 및 방법
1. 시약 및 시료
분석에 사용된 린코마이신 표준품(≥98%)은 Dr. Ehrenstofer GmbH (Augsburg, Germany)에서 구입하여 사용하였다(<Table 2> 참조). HPLC-MS/MS 분석에 사용된 아세토니트릴(acetonitrile, ACN) 및 증류수는 Merck사(Whitehouse station, NJ, USA)에서 구입하였다. 시료의 전처리에 사용된 고상추출 카트리지(solid-phase extraction, SPE)는 Waters사(MA, USA)의 Oasis HLB (Hydrphilic-Liphophilic Balance, 6 cc, 500 mg)를 사용하였고, syringe filter는 Advantec사(Toyo Roshi Kaisha Ltd., Tokyo, Japan)의 0.2 ㎛ PVDF (Polyvinylidene fluoride)를 사용하였다. 혈액시료의 분리는 BD사(Franklin Lakes, NJ, USA)의 5 mL 혈청 분리 진공 채혈관(Serum separation tubes, SST)을 사용하였다. 그 외의 시약들은 모두 Merck사(Whitehouse station, NJ, USA)에서 구입하여 사용하였다. 넙치(평균 200 g) 음성검체 시료는 경남 소재 양식장에서 구입 직전 린코마이신 불검출을 확인하였으며 근육은 껍질 및 내장을 제거한 부위만을 분쇄하여 균질화 하였고, 혈액은 SST를 사용하여 4000 x g에서 원심분리 후 혈청을 분리하였다. 모든 음성검체는 분리 즉시 초저온 냉동고(-70℃)에서 분석 당일까지 보관하였다.
2. 표준용액 조제
린코마이신 표준품 10 mg을 10 mL 볼륨플라스크에 취하고 메탄올에 용해시켜 1000 mg/L 농도의 항생제 표준원액(standard stock solution)을 조제하였다. 표준희석용액(working standard solution)은 분석 직전에 메탄올로 0.5, 1, 10, 50 ㎍/L로 단계희석 후 사용하였다. 린코마이신의 안정성은 표준원액을 1개월간 냉동보관(-20℃)했을 때 역가변동 없이 안정하였다.
3. 시료전처리
균질화한 근육(2 g) 또는 혈청(0.5 mL)을 50 mL 원심분리관에 취하고 메탄올 6 mL를 가하여 10분간 원심분리(4℃, 10,000 x g)하였다. 상층액은 새로운 15 mL 튜브에 옮겨 50℃ 수욕상에서 질소농축을 통해 완전히 증발시킨 후 잔사는 0.2 M 인산완충용액(pH 7.2) 6 mL로 정용하였다. 최종 정용된 추출액을 고상추출하기 위해 미리 메탄올 및 증류수 각 5 mL로 활성화시킨 HLB cartridge에 정용 추출액을 흡착시킨 후 5% 메탄올이 첨가된 증류수 5 mL로 세척하여 메탄올 6 mL로 완전히 용리시켰다. 최종 추출액은 50℃ 수욕상에서 완전히 질소농축 후 잔류물을 0.1% 개미산이 첨가된 메탄올 1 mL에 녹여 0.2 ㎛ PVDF syringe filter로 여과 후 HPLC-MS/MS로 분석하였다([Fig. 1]).
4. 기기분석 조건
넙치의 근육 및 혈청 내 린코마이신 잔류량 분석에 사용된 기기는 Agilent 1260 Infinity series LC (Agilent Technologies, Santa Clara, CA, USA)에 6430 triple quad MS detector가 부착된 HPLC-MS/MS를 사용하였다. 고정상 및 이동상은 C18 column (Agilent Zobrax RRHD SB, 2.1x50 mm, 1.8 ㎛)에 0.1% 개미산이 첨가된 아세토니트릴과 0.1% 개미산이 첨가된 증류수를 70:30(v/v, %)의 비율로 등용리조건(isogratic)하에서 2분간 분석하였다.
이때 column 온도는 40℃를 유지하였으며, 유속은 0.25 mL/min으로 하였다. MS/MS 검출기는 양이온(positive) 모드로 하였고, capillary voltage 4000 V, nebulizer gas는 질소를 사용하였으며 나머지 세부 조건들은 <Table 3>에 나타내었다. 질량분석기를 통해 양이온 모드에서 선구이온을 검출하고 최적화된 충돌 에너지(collision energy)를 선택한 다음 조각이온을 탐색하여 정성 및 정량 이온을 결정하는 multiple reaction monitoring (MRM)으로 분석조건을 확립하였다. 모든 분석은 Mass hunter software (Ver.B.00.06.32, Agilent Technology)를 사용하여 처리하였다.
5. 분석법 검증
본 분석법의 검증은 국제식품규격위원회의 guideline (CAC/GL 71-2009, 2014) 및 유럽연합의 기준을 준용하여 특이성(specificity), 직선성(linearity), 정밀성(precision), 정확성(accuracy), 검출한계(Limit of detection, LOD) 및 정량한계(Limit of quantitation, LOQ)로 평가하였다. 직선성은 음성시료에 4가지 농도 수준(0.5~50 ng/g)으로 spiked 시료를 이용하여 조직표준곡선(matrix-matched calibration, MMC)으로 측정하였고 정확성은 정량한계 농도로 표준용액이 spiked 된 시료의 회수율로 측정하였다. 정밀성은 회수율에 영향을 미치는 다양한 요인을 반영하여 상대표준편차(relative standard deviation, %)로 측정하였다. 검출한계와 정량한계는 각각 spiked 시료로부터 signal-to-noise ratio가 3 및 10이 되는 수준으로 설정하였다.
Ⅲ. 연구 결과
1. HPLC-MS/MS 조건 확립
식품공전에서 수산물 중 린코마이신 분석조건을 참고하여(KFDA, 2021) 이동상 조성 및 이온소스 비율 등을 고려한 넙치시료의 최적화된 분석법을 확립하였다. <Table 3>과 같이 질량분석기의 조건은 식품공전에서 제시한 선구 및 조각 이온간 패턴이 유사하였으며, 액체크로마토그래피는 이동상 조성을 각 0.1% 개미산이 첨가된 아세토니트릴과 증류수를 등용리조건으로 구성하여 최적의 조건을 확립하였다. 본 조건에서 린코마이신은 매우 신속하게(머무름시간, 0.564분) 피크가 검출되었으며 샘플당 2분의 분석시간이 소요되었다.
2. 넙치시료 전처리 방법 확립
시료의 추출법은 대표적으로 LLE (liquid-liquid extraction) 및 SPE 방법이 사용되며, 본 연구에서는 SPE를 이용하여 린코마이신 추출에 적용하였다. 식품공전에서 사용한 SPE는 C18을 사용하였지만, 본 연구에서는 비교적 범용성 SPE인 HLB를 사용하였다. 또한 넙치 근육 및 혈액에서 린코마이신 추출용매로서 식품공전에서 제시한 아세토니트릴을 메탄올로 변경하여 조직 중 타겟의 원활한 추출을 유도하였다.
3. 특이성 및 직선성
넙치시료에 존재하는 다양한 매트릭스 성분들 중 린코마이신을 특이적으로 간섭현상 없이 검출이 가능한지 확인하기 위해 특이성을 평가하였다.
그 결과 표준품과 조직 중 린코마이신의 머무름시간이 일치하여 넙치 근육 및 혈액의 다양한 매트릭스로부터 린코마이신을 특이적으로 검출할 수 있었다([Fig. 2]).
![[Fig. 2] [Fig. 2]](/xml/31459/KSFME_2021_v33n6_1368_f002.jpg)
Total ion chromatograms: (A) standard solution at 10 ng/mL; (B) blank muscle spiked with lincomycin at 10 ng/mL; (C) blank serum spiked with lincomycin at 10 ng/mL.
직선성은 넙치 조직표준곡선으로 검량선을 작성한 결과, 근육 및 혈청에서 상관계수가 모두 0.99이상으로 나타나 CODEX guideline을 충분히 만족하였다([Fig. 3]).
4. 정확성, 정밀성 및 정량한계
정확성은 정량한계 농도로 일내 및 일간 반복 실험하였을 때 근육 및 혈액 모두 89%이상으로 조직에서 린코마이신의 회수율이 우수하였다(<Table 4> 참조). 실험실 내 정밀성은 상대표준편차로 산출한 결과 8.95%로서 유럽연합(Comission Decision 2002/657/EC)에서 권고하는 20% 이하를 만족하여 우수한 정밀성을 나타내었다. 정량한계는 근육 및 혈청에서 모두 0.5 ng/g수준으로, 현재 어류의 잔류허용기준인 100 ng/g보다 200배 민감한 수준으로 정량 가능함을 나타내었다.
Ⅳ. 고 찰
축·수산물 중 린코마이신의 정량분석 가능한 방법은 이미 식품공전에서 제시하고 있다(KFDA, 2021). 그러나 이러한 분석방법은 샘플을 처리하기 위한 긴 분석시간이 요구되며 가식부위(근육 등)에 한정적으로 마련되어 있다. 또한 어류는 축산동물과는 달리 어종이 다양하여 분석 매트릭스에 특이적인 전처리법이 필요하다. 넙치에서 린코마이신의 신약허가를 위해 혈액 및 근육에서 약동학적 잔류모델 구축이 절실히 요구되며, 이에 따라 본 연구에서는 넙치시료에서 분석 감도가 우수한 린코마이신 정량분석법을 개발하였다. 어류는 잔류분석 시 개체간 차이가 심하여 국제적으로 샘플링 구간 당 최소 10마리 이상을 권고하고 있으며 우리나라에서는 「수산용 동물용의약품등 잔류성 시험지침」(국립수산물품질관리원 행정규칙)에 따라 15마리를 분석하도록 고시하고 있어, 어류 잔류시험에서는 많은 샘플을 단시간에 처리가능한 방법이 필수적이다. 따라서 본 연구에서는 샘플 당 신속한 분석시간(2분) 및 국제적 가이드라인에 준수한 특이성, 직선성, 정확성 및 실험실 내 정밀성 분석을 통해 검증하였고, 기존의 식품공전 분석법을 일부 변형한 넙치 시료의 특이적인 고감도 HPLC-MS/MS법을 개발하였다. 향후 본 분석법은 넙치에서 린코마이신의 잔류 약동학 모델 구축을 위한 정량분석법으로 활용할 계획이다.
Ⅴ. 결 론
본 연구에서는 린코마이신의 넙치 약동학 모델에 적용가능 한 고감도 잔류분석법을 개발하였다. 식품공전에서 제시하고 있는 수산물 중 린코마이신의 잔류분석법을 참고하여 넙치 근육 및 혈액에서 반복 분석 후 정량한계는 모두 0.5 ng/g으로 어류 잔류허용기준인 100 ng/g보다 200배 민감한 수준으로 매우 적합한 분석법으로 나타났다. 또한 본 분석법의 특이성, 직선성, 정확성 및 정밀성은 국제식품규격위원회의 guideline (CAC/GL 71-2009, 2014) 및 유럽연합(Comission Decision 2002/657/EC)에서 권고하는 국제적 기준에 충족하여, 넙치 매트릭스에서 충분히 활용 가능한 분석법이다.
Acknowledgments
이 논문은 국립수산물품질관리원 수산생물 방역기술 개발 및 프로그램 운영 지원에 의해 수행되었음.
References
- CAC/GL 71-2009(2014). Codex Alimentarius Committee. Retrieved from http://www.fao.org/fao-who-codexalimentarius/sh-proxy/it/?lnk=1&url=https%253A%252F%252Fworkspace.fao.org%252Fsites%252Fcodex%252FStandards%252FCXG%2B71-2009%252FCXG_071e_2014.pdf
-
Collignon P(2008). Clinical importance of antimicrobial drugs in human health. In: Collignon, P., Courvalin, P., Aidara-Kane, A. (Eds.), Guide to Antimicrobial Use in Animals. Blackwell Publishing, UK, 44~58.
[https://doi.org/10.1002/9781444302639.ch4]

- Commission Decision 2002/657/EC(2002). Implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results. Retrieved from https://op.europa.eu/en/publication-detail/-/publication/ed928116-a955-4a84-b10a-cf7a82bad858/language-en, on July 28.
- KFDA(2021). Ministry of food and drug safety. Retrieved from https://www.foodsafetykorea.go.kr/foodcode/, .
- Kim YJ, Chun WK, Cho EA and Kim DH(2019). Determination of epidemiological Cut-off Values for lincomycin and tylosin in Streptococcus parauberis. Korean Federation of Fisheries Science and Technology Societies, 233~233.
-
Lee JH, Kim GW, Kwon MG and Seo JS(2021). Pharmacokinetic-Pharmacodynamic Profile, Bioavailability, and Withdrawal Time of Tylosin Tartrate Following a Single Intramuscular Administration in Olive Flounder (Paralichthys olivaceus). Animals, 11(8), 2468.
[https://doi.org/10.3390/ani11082468]

-
Lim JW, Jung MH, Jung SJ, Kim DH, Park KH and Kang SY(2017). The efficacy of amoxicillin sodium against streptococcosis in cultured olive flounder Paralichthys olivaceus and its pharmacokinetics. Journal of veterinary pharmacology and therapeutics, 40(1), 77~87.
[https://doi.org/10.1111/jvp.12321]

-
Lin AH, Murray RW, Vidmar TJ and Marotti KR(1997). The oxazolidinone eperezolid binds to the 50S ribosomal subunit and competes with binding of chloramphenicol and lincomycin. Antimicrob Agents Chemother. 1997 Oct;41(10): 2127-31.
[https://doi.org/10.1128/AAC.41.10.2127]

- NFQS(2020). Aquatic medicine catalog, 4~11
- NIFS(2016). Olive flounder aquaculture standard manual, 8~9
- Papich MG and Riviere JE(2009). In: Riviere, J.E., Papich, M.G. (Eds.), Chloramphenicol and Derivatives, Macrolides, Lincosamides, and Miscellaneous Antimicrobials. Veterinary Pharmacology & Therapeutics, 9th ed., 963~965.
-
Pyörälä S, Baptiste KE, Catry B, Van Duijkeren E, Greko C, Moreno MA, Pomba MCMF, Rantala M, Ružauskas M, Sanders P, Threlfall EJ, Torren-Edo J and Törneke K(2014). Macrolides and lincosamides in cattle and pigs: use and development of antimicrobial resistance. The Veterinary Journal, 200, 230~239.
[https://doi.org/10.1016/j.tvjl.2014.02.028]


![[Fig. 1] [Fig. 1]](/xml/31459/KSFME_2021_v33n6_1368_f001.jpg)
![[Fig. 3] [Fig. 3]](/xml/31459/KSFME_2021_v33n6_1368_f003.jpg)