
겨울철 동남권 전통시장에서 판매되는 조개젓갈의 미생물학적 오염도 조사
Abstract
This study evaluated the microbial contamination levels of five types of shellfish jeotgal sold in traditional markets in the southeastern region of Korea during winter. The experiment analyzed the contamination levels of hygiene indicator bacteria (total viable bacteria, coliforms, and Escherichia coli), fungi, and food-borne pathogenic bacteria (Staphylococcus aureus, Clostridium perfringens, Bacillus cereus, Salmonella spp., Listeria monocytogenes, Campylobacter jejuni/coli, Yersinia enterocolitica, Enterohemorrhagic Escherichia coli (EHEC), Vibrio parahaemolyticus). The results showed that the aerobic plate count and fungal counts were 2.95 (2.47–3.18) and 0.82 (ND–1.65) log CFU/g, respectively. Coliforms, E. coli, and all tested foodborne pathogens were not detected. The microbial contamination levels identified in this study provide fundamental data for the microbiological risk assessment of salted shellfish.
Keywords:
Shellfish jeotgal, Food-borne pathogenic bacteria, Microbial contaminationI. 서 론
우리나라는 삼면이 바다로 둘러싸여 있고, 한류와 난류가 교차하고 있어 다양한 종류의 수산물이 서식하기 때문에 많은 종류의 수산물을 전통적으로 섭취하여 왔다(Choi et al., 2018). 수산물은 수분 함량이 높고 영양가가 풍부하지만, 일반식품과 달리 어획 후 품질이 쉽게 떨어지거나 부패하는 특징이 있다(Song et al., 2022). 이런 이유 때문에 저장 기술이 발달하지 않았던 시기에는 염장을 통해 유해 미생물의 성장을 억제시켜 수산물을 장기간 보관하였다(Choi et al., 2018). 염장을 이용한 젓갈, 식해 등의 수산발효식품은 수산식품의 발전에 기여했으며, 오늘날에도 그 저장성과 더불어 고유한 맛과 영양적 가치를 보유하고 있기 때문에 많은 사람들이 찾는 애호 식품이다(Lee et al., 2022).
그 중 젓갈은 근육, 내장 또는 생식소 등에 소금을 20–30%(w/w) 첨가하여 숙성 후 직접 섭취하거나 여러 가지 식품의 맛 향상을 위한 부재료로 사용한다(Kim et al., 2009; Song et al., 2022). 이는 발효과정에서 소금에 의해 미생물 분해가 활성화되어 생성되는 분해 산물에 의해 감칠맛과 풍미가 형성되기 때문이다(Choi et al., 2019; Lee et al., 2024). 젓갈은 원료와 지역별 제조 방법에 따라 160종 이상의 젓갈이 존재하는 것으로 알려져 있으며, 30종정도가 상업적으로 판매된다(Guan et al., 2011). 이 중 대표적인 패류 젓갈의 하나인 조개젓갈은 바지락, 백합, 모시조개, 대합 등의 조갯살을 이용하여 제조되고 있으며, 생산량은 1995년 35M/T에서 2018년 145M/T으로 증가하는 추세를 보였다(Han and Jang, 2022). 그러나 조개젓갈의 주원료인 패류는 연안의 분변, 생활폐수 등의 오염원으로부터 영향을 받아 유해 미생물이 쉽게 축적될 가능성이 있으며(Kim et al., 2021), 이를 날것으로 섭취할 경우 식중독 위험이 높아질 수 있다. 또한 젓갈에 첨가되는 소금은 생산과정에서 염전 및 주위 환경으로 인한 오염 가능성 때문에 젓갈 제조과정에서 교차오염이 일어날 수 있다(Kim et al., 2009). 우리나라는 2019년 중국에서 수입한 조개젓갈로 인해 A형 간염바이러스가 대규모 발병한 사례가 있었다(Han et al., 2021). 2011년–2022년까지 매년 A형 간염바이러스 신고 환자는 평균 3,154명 정도였으며, 특히 2019년 오염된 조개젓으로 인해 신고 환자 수가 17,598명으로 급증하였다(Kim et al., 2024). 아울러 Choi et al.(2018)의 연구에 따르면 조개젓갈의 일반세균수 검출량이 5.9log CFU/g로 높은 오염 수준을 보였다.
전통시장에서 판매하는 젓갈을 포함한 반찬류는 보통 상온에서 진열, 보관되어 별도의 개별 포장 없이 판매되는 경우가 대부분이었으나, 최근에는 위생에 대한 관심이 높아지며 덮개나 여닫이문이 있는 냉장보관 시스템을 이용하여 외부와의 접촉을 차단하기도 하지만 판매자가 즉석에서 포장하는 과정 등에서 공기 중의 먼지나 위해 미생물에 교차 오염될 가능성도 있다(Um et al., 2023).
겨울철에는 기온이 낮아 식중독 위험이 줄어든다고 생각하기 쉽다. 실제로 식중독 환자 수는 기온 16℃를 기점으로 발생관계가 다르게 나타나며 기온이 낮을수록 식중독 발생 환자 수는 감소하는 경향이 있다(Shin et al., 2009). 그러나 낮은 기온이라고 해서 식중독 위험을 간과할 수는 없다. 여름철에 식중독 발생률이 상대적으로 높지만, 겨울철에도 세균이 완전히 소멸하는 것은 아니므로 철저한 위생 관리와 식중독 검사가 필요하다.
따라서 본 연구는 겨울철 전통시장에서 유통 중인 조개젓갈을 대상으로 위생지표 세균(일반세균수, 대장균군 및 대장균) 및 진균의 오염 실태와 식중독균(황색포도상구균, 바실러스 세레우스, 클로스트리디움 퍼프린젠스, 살모넬라, 리스테리아 모노사이토제네스, 캠필로박터 제주니/콜리, 여시니아 엔테로콜리티카, 장출혈성 대장균, 장염비브리오)에 대한 정성 및 정량 분석하여 오염 실태를 조사하고자 한다.
Ⅱ. 연구 방법
1. 실험 재료
본 연구에서 사용한 조개 젓갈은 미생물 오염도 조사를 위해 통영(2건), 마산(2건), 부산(1건)에 소재하고 있는 전통시장에서 2025년 1월에 구매하였다. 구매 당시 시료는 진열대에 전시되어 있었으며, 주변 온도는 약 7℃이었다. 시료는 아이스박스에 아이스팩을 동봉하여 저온상태를 유지한 후, 실험실로 운반하였으며, 당일 도착하여 냉동실(-18℃)로 옮겨 보관 후 48시간 이내 실험분석에 사용하였다. 아울러 실험에 사용된 집게 및 가위는 멸균하여 사용하였다.
2. 일반세균수, 대장균군 및 대장균 정량 분석
일반세균수, 대장균군 및 대장균은 식품공전(MFDS, 2024) 미생물 시험법에 준하여 시행하였다. 일반세균수 측정은 각각의 시료 25g을 멸균필터백에 취한 후 멸균생리식염수 225mL를 가하여 균질기(BagMixer® 400, Interscience, Saint-Nom la Bretèche Arpents, France)를 사용하여 2분간 균질화하였다. 균질화된 시험용액 1mL와 10배 단계 희석액 1mL씩을 petri dish 2매에 무균적으로 취한 후 plate count agar(PCA; Difco Co., Detroit, MI, USA)를 약 15mL를 분주하고 혼합 후 확산집락의 발생을 억제하기 위해 3–5mL의 plate count agar를 가하여 중첩하였다. 이 후 37℃에서 48시간 배양하였다. 집락수 계산시 확산집락이 없는 평판당 15–300개의 집락을 생성한 평판을 선택하여 계산하였다.
대장균과 대장균군은 정량분석을 위해 건조필름 3M Petrifilm(coliforms/E. coli Count Plate, 3M Korea)을 이용하였고 일반세균수 균질액을 1mL씩 2매의 건조필름에 분주한 후 35±1℃에서 24±2시간 배양 후 대장균군은 주위에 기포를 형성한 붉은 집락을 계수하였고, 대장균은 주위에 기포를 형성한 푸른 집락을 계수하였다.
3. 진균류 정량 분석
진균류는 식품공전(MFDS, 2024) 방법에 준하여 시행하였다. 일반세균수와 동일한 균질액 0.1 mL를 10% 주석산을 이용하여 산성화시킨 potato dextrose agar(PDA; Difco Co., Detroit, MI, USA)에 접종하여 도말 후 25℃에서 3일간 배양한 뒤 집락이 없거나 너무 작으면 2일 동안 추가 배양하였다. 평판당 10–150개의 집락을 계수하였으며, 10개 미만의 집락일 경우 희석수가 가장 낮은 것으로 측정하였다.
4. 식중독균의 정량 및 정성 분석
식중독균 실험은 총 9종류로 황색포도상구균, 바실러스 세레우스, 클로스트리디움 퍼프린젠스, 살모넬라, 리스테리아 모노사이토제네스, 캠필로박터 제주니/콜리, 여시니아 엔테로콜리티카, 장출혈성 대장균 및 장염비브리오를 선정하였으며, 식품공전(MFDS, 2024) 방법에 준하여 시행하였다.
황색포도상구균, 바실러스 세레우스 및 클로스트리디움 퍼프린젠스의 정량 분석을 위해 일반세균수와 동일한 균질액을 10배 단계 희석하여 사용하였다.
황색포도상구균은 baird-parker agar(BPA, Difco Co., Detroit, MI, USA)를 3장의 페트리디시에 분주하여 굳힌 다음 단계별로 희석액을 0.4mL, 0.3 mL, 0.3mL씩 총 1mL가 되게 spread하여 35–37℃, 48±3시간 배양한 다음 투명한 띠로 둘러싸인 광택의 검정색 집락을 계수하였다.
바실러스 세레우스는 mannitol egg yolk polymyxin agar(MYP, Difco Co., Sparks, MD, USA)를 3장의 페트리디시에 분주하여 굳힌 다음 단계별로 희석액을 0.4mL, 0.3mL, 0.3mL씩 총 1mL가 되게 도말하여 30℃에서 24±2시간 배양한다음 분홍색 집락을 계수하였다.
클로스트리디움 퍼프린젠스는 petri dish에 균질액 1mL씩 분주하고, tryptose sulfate cyclosrine agar(TSC, MBCell, Seoul, Korea) 10–15mL를 부어 혼합하여 응고시켰다. 그 후 응고된 배지위에 동일한 배지 10 mL를 가하여 중첩시킨 후 35–37℃에서 24±2시간 혐기 배양하였다. 전형적인 검은색 집락을 선별하여 계수하였다.
살모넬라의 정성분석을 위해 시료 25g과 buffered peptone water(BPW, MBCell, Seoul, Korea) 225mL를 균질기를 사용하여 약 2분간 혼합한 후 36±1℃에서 18–24시간 배양하였다. 이 후 10 mL의 Rappaport-vassiliadis broth(RV, Difco Co., Detroit, MI, USA)에 배양액 0.1mL첨가함과 동시에 10mL Tetrathionate(TT, Oxoid Ltd., Hampshire, UK) 배지에 1 mL의 배양액을 첨가하여 각각 41.5±1℃ 및 36±1℃에서 20–24시간 증균배양한다. 이후 xylose lysine deoxycholate agar(XLD, Difco Co., Sparks, MD, USA) 및 BG sulfa agar(Brilliant green, Difco Co., Sparks, MD, USA) 배지에 증균배양액을 획선도말한 후 36±1℃에서 20–24시간 배양 후 빨간색 혹은 검은색 집락을 관찰하였다.
리스테리아 모노사이토제네스의 정성분석을 위해 시료 25g과 listeria enrichment broth(Oxoid, Hampshire, UK) 225mL를 균질기를 사용하여 혼합한 후 30℃에서 48시간 배양한다. 이후 PALCAM(Oxoid, Hampshire, UK) 한천배지에 획선도말하여 35–37℃에서 24–48시간 배양한 후 의심집락이 확인되면 tryptic soy agar(TSA, Difco Co., Detroit, MI, USA)에 접종하여 30℃에서 24–48시간 배양하였다.
캠필로박터 제주니/콜리의 정성분석을 위해 시료 25g과 preston broth(MBCell, Seoul, Korea) 100 mL를 혼합하여 35–37℃에서 4–5시간 미호기적으로 1차 증균 후, 42±1℃에서 44±4시간 미호기적으로 2차 증균 배양하였다. 이후 2차 증균배양액을 preston agar(MBCell, Seoul, Korea)에 획선도말하여 42℃에서 24–48시간 미호기적 암소에서 배양한 다음 불규칙한 원모양을 형성하는 반투명의 흰색집락을 계수하였다.
여시니아 엔테로콜리티카의 정성분석을 위해 시료 25g과 peptone sorbitol bile broth(PSBB, MBCell, Seoul, Korea) 225mL를 가함과 동시에 PSBB 배지를 가한 시험용액 10mL를 취하여 irgasan ticarcillin and potassium chlorate broth(ITC, MBCell, Seoul, Korea) 90mL에 가한 후 혼합하여 25℃에서 48시간 증균배양하였다. 증균배양액 0.1 mL를 0.5% KOH가 함유된 0.5% 식염수 1 mL에 가하여 골고루 혼합하여 macconkey agar(Difco)와 cefsulodin irgasan novobiocin agar(CIN, MBCell, Seoul, Korea)에 각각 접종하여 30℃에서 24±2시간 배양하였다.
장출혈성 대장균의 정성분석을 위해 시료 25g과 modified tryptone soya broth(mTSB, Oxoid, Hampshire, UK) 225mL를 혼합하여 35–37℃에서 24시간 증균배양하였다. 이후 tellurite cefixime sorbitol macconkey agar(TC-SMAC, Difco Co.)와 5-bromo-4-chloro-3indolyl β-D-glucuronide(BCIG, Difco Co.)에 획선도말하여 35–37℃에서 18–24시간 배양하였다.
장염비브리오의 정성분석을 위해 시료 25g과 alkaline peptone water(APW, Difco Co.) 225mL를 혼합한 후 35–37℃에서 18–24시간 동안 증균배양하였다. 이후 증균배양액을 thiosulfate citrate bilesalt sucrose agar(TCBS, Oxford formulation, Oxoid, Hampshire, UK)에 획선도말하여 35–37℃에서 18–24시간 배양한 후 청록색의 서당(sucrose) 비분해 집락을 계수하였다.
Ⅲ. 연구 결과
1. 위생지표 세균(일반세균수, 대장균군/대장균) 정량 분석
일반세균수는 인체에 직접적인 위해를 주는 요소는 아니지만, 일반적인 검출 수준보다 높을 경우 병원성 미생물의 오염 가능성을 예측할 수 있다(Um et al., 2023). 식품공전(MFDS, 2024)에 따르면, 위생처리된 수산물의 일반세균수 기준은 n=5, c=2, m=100,000, M=500,000으로 설정되어 있으며, Solberg et al.(1990)은 비조리 식품의 일반세균수 안전기준을 6log CFU/g으로 제시하였다. 본 연구의 전통시장에서 유통되는 조개젓갈의 위생지표세균(일반세균수, 대장균군 및 대장균) 오염도 분석 결과를 <Table 1>로 제시하였다. 조개젓갈의 평균 일반세균수는 2.95log CFU/g이었으며, 범위는 최소 2.47log CFU/g, 최대 3.18log CFU/g을 보였다. 이는 Lee et al.(2008) 연구에서 조개젓갈 일반세균수로 보고한 4.2log CFU/g보다 낮은 수치이다. Choi et al.(2018)의 연구는 젓갈에 양념의 유무에 따른 실험을 진행하였으며 양념 젓갈의 경우에는 5.4log CFU/g이 검출된 반면, 본 연구와 동일한 양념을 가하지 않은 젓갈에서는 3.5log CFU/g이 검출되었다. 본 연구에서 분석한 조개젓갈은 식품공전(MFDS, 2024)과 Solberg et al.(1990)이 제시한 안전기준치보다 낮아 위생적으로 안전한 수준임을 확인할 수 있었다.
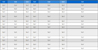
Contamination level of total viable bacteria, coliforms, and Escherichia coli in shellfish jeotgal distributed in the market
대장균군은 장내세균으로 분변오염을 나타내는 지표 세균 중 하나이며, Escherichia spp., Salmonella spp., Shigella spp.와 같은 병원성 세균이 존재할 가능성을 암시한다(Song et al., 2022). 대장균군은 장기간 생존하는 특성 때문에 식품의 비위생적 취급 및 비위생적 환경을 나타내어 오염지표로 사용된다(Kim, 2021). 대장균은 식품의 분변 오염 여부를 직접적으로 정확하게 판단할 수 있으며 젓갈과 같은 즉석 식품에서 절대 검출되어서는 안 되는 세균이다. Choi et al.(2018)의 연구에 의하면 젓갈 16건 중 대장균군 및 대장균이 검출되지 않았다고 보고하였으며, 이는 본 연구와 동일한 양념을 하지 않은 젓갈이며 본 연구에서도 대장균군 및 대장균은 검출되지 않았다. 반면 양념젓갈은 대장균군이 35건 중 17건이 검출되었다고 보고하였다. 이를 바탕으로, 젓갈에서 대장균군 및 대장균의 오염은 양념 과정에서 교차오염이 발생할 가능성이 있음을 시사한다. 식품의약품안전처(MFDS, 2024)의 식품공전에 따르면, 즉석 섭취 식품에서 대장균군의 검출 기준은 음성으로 규정되어 있으며, 본 연구의 결과는 해당 기준을 충족하였다. 다만, 젓갈의 가공 및 유통 단계에서 위생적인 원료 관리, 철저한 개인위생 준수, 제조 환경의 청결 유지를 하여 교차오염을 방지해야 한다고 사료된다.
2. 진균류 정량 분석
곰팡이와 효모를 합친 진균류는 다양한 자연환경에서 발견되며, 진균류는 식품내 세균과 공존하여 식품을 오염시킨다(Kim et al., 2024). Gwak et al.(2012)의 연구에 따르면 공기 중에는 Cladosporium sp., Penicillium sp., Aspergillus sp.와 같은 곰팡이 균종이 존재하여, 가공 및 유통 과정에서 공기 중 존재하는 포자가 식품에 떨어져 오염이 발생한다. 이는 외관상 불쾌감을 줄 뿐만 아니라 품질저하 및 곰팡이 독소에 의한 건강장애를 유발할 수 있다(Gwak et al., 2011). 곰팡이는 다른 미생물과 다르게 특정 조건영양소를 필요로 하지 않으며, 다양한 효소를 분비하여 성장이 가능하기 때문에 대부분의 식품에 존재할 수 있다(Gwak et al., 2012). 본 연구에서 분석한 조개젓갈 5건 중 3건에서 진균류가 검출되었다. 검출된 평균 오염 수준은 1.37log CFU/g로 나타났으며, 범위는 ND–1.65log CFU/g으로 보였다. Choi et al.(2019)의 저염 명란 및 저염 오징어 젓갈에서는 진균류가 2–3log CFU/g 수준으로 검출되었으며, 본 연구보다 다소 높은 수치이다. 이는 조개젓갈이 가공 및 판매 과정에서 공중낙하균에 의해 진균이 검출 되었을 거라고 판단된다. Kwon et al.(2012)의 깻잎 재배농장 공기 오염도를 판단하기 위해 공중낙하균을 분석하였을 때 곰팡이가 검출되었다. 진균은 젓갈의 품질과 안전성에 영향을 미칠 수 있으며, 젓갈의 미생물학적 안전성을 유지하기 위해서는 가공, 유통 및 판매 단계에서 진균류에 대한 위생체계가 구축되어야 한다.
3. 식중독균 정량 분석
황색포도상구균, 클로스트리디움 퍼프린젠스 및 바실러스 세레우스 정량적 분석은 <Table 3>으로 나타내었다. 황색포도상구균은 강한 저항성 때문에 토양, 공기 등 자연계에 광범위하게 분포하며 사람과 동물의 피부에도 생존하고 있어 식품으로의 오염경로가 매우 다양하다(Bae and Park, 2007). 황색포도상구균 식중독은 균이 식품에서 증식하면서 생성된 독소를 섭취함으로써 발생하는 독소형 식중독이다(Kang et al., 2002). 사람에게는 화농성 질환을 유발하여 괴사 및 농양을 유발하기 때문에 식품 안전상 중요하게 다루어지는 균 중 하나이다(Kim et al., 2024). 본 연구에서 5건의 조개젓갈에서 황색포도상구균은 다행이도 검출되지 않았다. Lee et al.(2008)의 연구결과 역시 총 554건의 시료에서 황색포도상구균이 검출되지 않았다. 그러나, 황색포도상구균은 높은 빈도로 검출되는 식중독균이며, 건강한 사람의 피부에도 존재를 할 수 있기 때문에 가공 및 판매 과정에서 취급자의 손을 통해서 오염될 가능성이 있다. 따라서, 황색포도상구균의 예방은 쉽지 않지만, 취급자의 개인 위생관리, 주변 환경의 세척 및 소독을 철저히 하는 것이 중요하며, 특히 피부 질환이 있는 경우 각별한 주의가 필요하다.

Contamination Levels of Staphylococcus aureus, Clostridium perfringens and Bacillus cereus in shellfish jeotgal Distributed in Traditional Markets
바실러스 세레우스는 토양미생물로 물, 토양 공기 등 자연계에서 흔히 발견되며, 식품에 혼입될 가능성이 많다(Kim et al., 2004). 이는 설사독소, 구토독소를 생산하여 식중독 증상인 설사 및 구토를 유발시키고 통상 3일 내 치료되는 것으로 보고되고 있다(Jeon et al., 2016). 대부분 증상이 경미하고 자연 치유되지만, 면역이 저하된 사람에게는 균혈증, 뇌수막염 및 폐렴 등으로 사망에 이르게 한 사례도 있다(Choi et al., 2011). 조개는 해양 퇴적물 속에서 서식하며 퇴적물에 포함된 유기물을 섭취하게 되는데, 섭취 과정에서 토양미생물인 바실러스 세레우스가 체내에 축적될 가능성이 있다. 본 연구에서 바실러스 세레우스는 검출되지 않았다. 그러나 Choi et al.(2018)의 연구에서는 양념을 가하지 않은 젓갈 16건 중 2건이 바실러스 세레우스가 검출되었고, 양념젓갈 경우에는 35건 중 20건이 검출되었다. 또한 저염 젓갈은 33건 중 19건, 기존 식염 함량 젓갈은 18건 중 3건이 검출되었다. 위 연구에서는 고춧가루나 양파 등 양념젓갈에 첨가되는 부재료가 주요 오염원으로 판단하였으며, 미생물 저감화 효과가 약할 수 있는 저염 젓갈의 경우 더욱 철저한 위생관리가 필요하다고 보고하였다. 실제로 바실러스 세레우스는 염분 7%에서 생존 가능한 것으로 알려져 있어 저염 젓갈에서의 검출 위험이 높고, 바실러스 세레우스 포자는 135℃에서 4시간 동안 가열하여도 견딜 수 있을 정도의 생존력을 가지고 있고 음식물에서 쉽게 포자를 형성하기 때문에 유통 식품에서 검출될 확률이 높다(Kim and Choi, 2009). 따라서 본 연구에서는 미검출 되었지만, 젓갈 원료의 취급 및 관리는 중요한 요소로 간주되며, 생산 과정에서 철저한 관리가 요구된다.
클로스트리디움 퍼프린젠스는 그람 양성 간균으로 혐기성 포자를 형성하며 토양 및 사람의 장관에 존재하며 감염 시 가스 괴저, 장염괴사 등을 보이는 식중독 균이다(Lee and Park, 2023). 클로스트리디움 퍼프린젠스는 식품의약품안전처 통계에 의하면 2013년–2022년까지 우리나라에 발생한 클로스트리디움 퍼프린젠스에 의한 발생건수 및 환자수는 143건 및 5,630명으로 세균성 식중독 원인균으로 4위에 해당한다. Skanavis and Yanko(2001)에 따르면 해양 퇴적물에서 클로스트리디움 퍼프린젠스가 검출되었다고 보고하였다. Lee and Park(2023)의 젓갈에서 클로스트리디움 퍼프린젠스를 분리한 논문에서는 낙지젓, 어리굴젓, 밴댕이젓, 조개젓 등에서 클로스트리디움 퍼프린젠스가 검출되었다. 클로스트리디움 퍼프린젠스는 최소가열 식품 및 농산물 등 젓갈의 원료에서 검출 가능성이 높다(Song et al., 2022). 본 연구결과에서는 미검출 되었지만 클로스트리디움 퍼프린젠스의 잠재적 검출 가능성이 있기 때문에 젓갈의 가공 및 유통 시에 철저한 관리가 필요할 것으로 사료된다.
4. 식중독균 정성 분석
살모넬라, 리스테리아 모노사이토제네스, 캠필로박터 제주니/콜리, 여시니아 엔테로콜리티카, 장출혈성 대장균, 장염비브리오는 <Table 4>로 나타내었다. 본 연구에서 타겟으로 설정한 식중독균은 검출되지 않았다.
살모넬라는 식중독 원인 중 가장 높은 비율을 차지하며, 패혈증, 장염, 위장염 등 다양한 질병을 유발시키는 인수공통전염병이다. 살모넬라는 유제품, 계란 등의 축산식품 뿐만 아니라 수산물인 어류 및 패류 등에서도 자주 검출되는데 이러한 경우에는 원료의 직접적인 오염보다는 생산과정, 부적절한 요리 및 보관 중에 교차오염이 원인이 될 수 있다(Jeon et al., 2021). 본 연구와 동일하게 Lee(2021)의 즉석섭취 반찬류 미생물학적 품질평가 연구에 따르면 젓갈에 살모넬라 균이 미검출되었다고 하였다. Moon(2009)의 연구에서는 토마토 추출액에 Salmonella enteritidis을 접종을 하였을 때 죽염이 살모넬라에 항균효과가 있다고 보고하였다. 그러나 Alves et al.(2022)의 연구에 따르면, 살모넬라에 오염된 식품을 취급한 장갑을 통해 다른 식품으로 병원균이 전이될 수 있는 것으로 나타났다. 따라서 젓갈에 살모넬라가 검출되지 않았지만, 판매 과정에서의 교차오염을 철저히 주의해야 한다.
리스테리아 모노사이토제네스는 혐기성 그람양성 간균으로, 토양, 물, 동물 분변, 식물 등 다양한 곳에서 발견되어, 식품에 오염될 수 있는 경로가 매우 다양하다(Jin et al., 2021). 또한 소독제, pH 조절 및 낮은 온도 등 다양한 제어 조건에도 견디며, 생물막을 형성하는 특성으로 인해 식품에서 장기간 생존할 수 있다(Jordan and McAuliffe, 2018). 리스테리아 모노사이토제네스에 감염되면 사람에게 치명적인 리스테리아증을 유발할 수 있으며, 이 때문에 식중독균 중 가장 높은 입원율을 보이는 균이다(Jemmi and Stephan, 2006). 본 연구에서는 리스테리아 모노사이토제네스가 검출되지 않았지만, Hwang et al.(2024)의 온라인에서 판매되는 신선편의식품에서 리스테리아 모노사이토제네스가 검출되었다. 대체적으로 신선편의식품에는 샐러드와 같은 야채가 포함되어 있는데 젓갈의 부원료 또한 대파 및 양파 등과 같이 다양한 채소가 들어간다. 이는 냉장 온도에서도 증식할 수 있고 젓갈의 부재료로 인해 교차오염이 가능하기 때문에 이에 따라 철저한 관리와 주의가 필요하다.
캠필로박터 제주니/콜리는 캠필로박터 속으로 급성 위장 질환을 일으키는 캠필로박터증의 원인균이며, 돼지, 소, 양과 같은 가축 및 해산물 등 다양한 경로를 통해 식품에 오염될 수 있다(Vondrakova et al., 2014). 실온(25-30℃)에서는 불안정하여 사멸되거나 증식되지 않지만, 냉장(4℃) 및 동결(0℃ 이하) 상태에서는 장기간 생존하는 균이다(Lee et al., 2024). Dong et al.(2021)의 연구에서는 우유를 보관장소 온도 기준으로 차이를 두었으며 25℃ 이상이 25℃ 이하보다 캠필로박터 제주니에 감염 확률이 더 높다고 보고하였다. Dong et al.(2021)의 연구자는 교차오염 방지, 살균온도 및 시간 관리, 유통온도, 가정에서의 온도 관리 중요성을 강조했으며, 본 연구에서도 젓갈에 캠필로박터 제주니/콜리균이 검출되지 않았지만, 캠필로박터균에 대한 지속적인 주의가 필요하다.
여시니아 엔테로콜리티카는 그람 음성의 소간균으로, 인체 감염은 드문 편이나 오염 시 급성 위장염, 말단 회장염, 장간막 임파절염, 골수염, 패혈증 등 다양한 질병을 유발할 수 있다(Chae et al., 2008). 여시니아 엔테로콜리티카는 저온에서 생존 및 증식할 수 있어 진공 포장 식품 및 기타 식품에서 검출될 확률이 있다(Gupta et al., 2015). Lee et al.(2021)의 연구에 따르면 여시니아 엔테로콜리티카는 농산물에서 식중독을 일으킬 수 있는 위해요소 중 하나이지만, 다른 식중독균에 비해 상대적으로 위험 수준이 낮다고 보고하였다. 국내에서의 발생 빈도가 낮아 관심이 적은 편이나, 교차오염 및 조리기구 위생에 철저히 신경 써야 한다.
장출혈성 대장균은 Shiga 독소를 생성하여 설사 뿐만 아니라 출혈성 장염 및 출혈성 요독증후군을 유발한다. 질병관리청은 장출혈성 대장균을 2급 법정감염병으로 지정할 만큼 우리나라에서 높은 발생률을 보이고 있다(Kim and Bae, 2024). Cho et al.(2017)의 연구에서 생닭과 조리된 닭에서 대장균을 분리한 결과, 생닭에서는 특정 혈청형과 독소 유전자가 검출되었으나, 조리된 닭에서는 병원성 대장균이 검출되지 않았다. 본 연구에서 장출혈성 대장균은 검출되지 않았지만, 젓갈은 날 것을 식염 및 부원료 첨가 외에는 따로 가열 조리를 하지 않기 때문에 원재료 및 젓갈 가공품에 대한 위생관리가 철저해야 한다고 판단된다.
장염비브리오는 그람 음성의 무포자 간균으로, 호염성 특성 때문에 해수에 존재하며 어패류 오염의 주요 원인균이다. 오염된 어패류를 날것으로 섭취하거나 충분히 가열하지 않으면 복통, 설사, 오한, 구토 등을 유발하는 급성 위장염을 일으킬 수 있다. Ham et al.(2002)의 연구에서는 장염비브리오가 검출되었는데 7-10월 하절기에 매우 높은 검출율을 보였고 기온이 하강함에 따라 검출율이 급격히 감소하였다. 장염비브리오는 저장 온도에 따라 생존율이 상이하게 나타나는데, Kim et al.(1986)의 연구에서는 18-30℃에서는 식중독균이 증가하는 반면, 냉장 온도 및 냉동 온도에서는 장염비브리오의 생존율이 감소하는 경향을 보였다. 젓갈은 어패류를 원료로 사용하여 가공되기 때문에 장염비브리오에 취약하다. 따라서 가공 단계에서의 위생 관리와 유통 및 판매 단계에서 저장 온도에 특별히 신경을 써야 한다고 판단된다.
Ⅳ. 결 론
본 연구는 동남권 전통시장에서 판매되는 조개젓갈의 미생물학적 안전성을 평가하기 위해 일반세균수, 대장균군/대장균, 진균 및 9종의 식중독균을 분석하였다. 분석 결과, 일반세균수는 2.95 log CFU/g으로 식품공전(MFDS, 2024)의 안전기준치 이하였으며, 진균은 5개 시료 중 3개 시료에서 1.37 log CFU/g 수준으로 검출되었다. 대장균군/대장균 및 9종의 식중독균들 모두 검출되지 않았지만, 조개젓갈은 원료를 가열하지 않고 소금으로만 가공되는 식품이기에 식중독균 오염에 취약할 수 있다. 따라서 가공, 유통 및 판매 과정에서 교차오염을 방지하기 위해 개인 위생관리, 환기, 조리기구 소독 등 철저한 위생관리가 필요하다. 본 연구에서 도출된 미생물 오염 수준은 조개젓갈의 미생물 위해평가를 위한 기초자료로 활용될 수 있으며, 생산 및 유통 단계에서 미생물 오염을 효과적으로 제어하기 위한 연구의 기반이 될 것으로 판단된다. 다만, 본 연구는 Choi et al.(2018)에서 51건의 시료를 조사한 바와 달리 우리의 연구에서는 적은 시료수로 인한 실험의 대표성을 확보하기에는 한계점이 있는 것으로 사료되었다.
References
- Chae HS, Kim JY, Kim JE, Yang YM, Jin KS, Shin BW, Kim SH and Lee JH(2008). Characteristics of Yersinia enterocolitica isolates from beef and pork carcass. Korean J. Vet. Serv, 31(2), 192~205.
-
Cho YS, Lee DY, Kim HE, Lee MK and Lee JY(2017). Prevalence and characterization of Diarrheagenic Escherichia coli Isolated from raw chicken and chilled chicken in Korea. J. Food Hyg. Saf., 32(2), 129~134.
[https://doi.org/10.13103/JFHS.2017.32.2.129]

-
Choi JB, Cheon HS, Chung MS and Cho WI(2019). Effects of glycine on microbial safety of low-salted squid and myungran jeotgal. Korean J. Food Sci. Technol, 51(2), 114~119.
[https://doi.org/10.9721/KJFST.2019.51.2.114]

-
Choi KB, Lim HS, Lee K, Ha GY, Jung KH and Sohn CK(2011). Epidemiological investigation for outbreak of food poisoning caused by Bacillus cereus among the workers at a local company in 2010. J Prev Med Public Health, 44(2), 65~73.
[https://doi.org/10.3961/jpmph.2011.44.2.65]

-
Choi SA, An SE, Jeong HG, Lee SH, Mun KH and Kim JB(2018). Evaluation of microbiological safety in commercial Jeotgal. Food Sci. Preserv., 25(2), 270~278.
[https://doi.org/10.11002/kjfp.2018.25.2.270]

-
Guan L, Cho KH and Lee JH(2011). Analysis of the cultivable bacterial community in jeotgal, a Korean salted and fermented seafood, and identification of its dominant bacteria. Food Microbiol., 28(1), 101~113.
[https://doi.org/10.1016/j.fm.2010.09.001]

-
Gupta V, Gulati P, Bhagat N, Dhar MS and Virdi JS(2015). Detection of Yersinia enterocolitica in food: an overview. Eur J Clin Microbiol infect Dis, 34, 641~650.
[https://doi.org/10.1007/s10096-014-2276-7]

- Gwak HJ, Lee HJ, Lee SH and Na HJ(2011). Identification and concentration of airborne microbes in food manufacturing plants. J. Food hyg. Saf., 26(4), 361~365.
- Gwak HJ, We GJ, Cho JI, and Na HJ(2012). Seafood and fungi. Safe Food, 7(3), 30~36.
- Ham HJ, Jin YH and Jung YT(2002). Distribution of Vibrio parahaemolyticus in fishery products, sold at Garak Wholesnle Market and Serological characteristics of isolated strains. J. Food Hyg. Saf., 17(3), 152~156.
-
Han IH and Jang HJ(2022). Antioxidant Activity of Low Salt Fermented Clam Prepared with Wheat Flour. J East Asian Soc Diet, 32(2), 85~92.
[https://doi.org/10.17495/easdl.2022.4.32.2.85]

-
Han S, Jo JY, Park SR, Choi C and Ha SD(2021). Impact of chlorine dioxide and electron-beam irradiation for the reduction of murine norovirus in low-salted “jogaejeotgal”, a traditional Korean salted and fermented clam. Int. J. Food Microbiol., 342, 109073.
[https://doi.org/10.1016/j.ijfoodmicro.2021.109073]

-
Hwang HS, Jeong JH, Kwon YH, Byun YJ, Park JY and Yun HC(2024). A study of microbial contamination in fresh-Cut and ready-to-Eat foods purchased from online markets. J. Food Hyg. Saf., 39(4), 335~342.
[https://doi.org/10.13103/JFHS.2024.39.4.335]

-
Jemmi T and Stephan R(2006). Listeria monocytogenes: food-borne pathogen and hygiene indicator. Rev Sci Tech, 25(2), 571~80.
[https://doi.org/10.20506/rst.25.2.1681]

-
Jeon DY, Yoon GB, Yoon YH, Yang SI and Kim JB(2016). Bacterial community of traditional doenjang in longevity area and antagonistic effect against Bacillus cereus. J Korean Soc Food Sci Nutr, 45(7), 1035~1040.
[https://doi.org/10.3746/jkfn.2016.45.7.1035]

-
Jeon EB, Kim JY, Song MG and Park SY(2021). Microbiological investigation of the frozen-raw sliced fishes for Sushi manufacturing. Korean J. Fish. Aquat Sci, 54(2), 224~230.
[https://doi.org/10.5657/KFAS.2021.0224]

-
Jin YH, Ryu SH, Kwak JE, Kim RR, Choi YH, Lee MS and Hwang IS(2021). Prevalence, virulence characteristics and antimicrobial resistance of Listeria monocytogenes isolated from salmon products. Korean J. Food Sci. Technol., 53(4), 495~500.
[https://doi.org/10.9721/KJFST.2021.53.4.495]

-
Jordan K and McAuliffe O(2018). Listeria monocytogenes in foods. Adv Food Nutr Res, 86, 181~213.
[https://doi.org/10.1016/bs.afnr.2018.02.006]

- Kang Y, Yoon SK, Jwa SH, Lee DH, Woo GJ, Park YS and Kim CM(2002). Prevalence of Staphylococcus aureus in Kimbab. J. Food. Hyg. Saf., 17, 31~35.
-
Kim HY, Chae SH and Yang JS(2024). Surveillance of Hepatitis A Virus and Its outbreak status in the Republic of Korea, 2019 to 2022. Public Health Weekly Report, 17(10), 404~417.
[https://doi.org/10.56786/PHWR.2024.17.10.2]

-
Kim JE, Kim JH and Jung IK(2009). Perception and utilization of salted seafood in Korean women. Hum. Ecol. Res., 47(6), 11~20.
[https://doi.org/10.17703/JCCT.2019.5.4.123]

-
Kim JH and Bae JM(2024). Characteristics of Enterohaemorrhagic Escherichia coli in Jeju Province, Korea: a study of registry routes from 2017 to 2023. J Med Life Sci, 21(3), 72~44.
[https://doi.org/10.22730/jmls.2024.21.3.72]

- Kim JM, Yoon JH, Ham KS, Kim IC and Kim HL(2009). Hazards for the sea salt production procedures and its improvement. Safe Food, 4(4), 8~13.
-
Kim JY, Jeon EB, Song MG, Kim JS, Lee JS, Heu MS and Park SY(2021). Risk analysis and safety assessment of microbiological and chemical hazards in the raw short-neck clams ruditapes philippinarum distributed in the Yeongnam and Honam Area during the spring season. Korean J Fish Aquat Sci, 54(6), 896~903.
[https://doi.org/10.5657/KFAS.2021.0896]

-
Kim MG and Choi JC(2009). Biotoxins involved in foodborne disease and their control enterotoxins and emetic toxin of B. cereus. Food Sci. Ind., 42(2), 2~19.
[https://doi.org/10.23093/FSI.2009.42.2.2]

-
Kim SH, Jeon EB, Park EH and Park SY(2024). Investigation of microbial contamination in fried fish paste, a ready-to-eat food distributed from traditional markets in Korea’s southeast region during summer. Korean J Fish Aquat Sci, 57(1), 15~22.
[https://doi.org/10.5657/KFAS.2024.0015]

- Kim YM, Lee MS and Lee DS(1986). The storage temperature effect on Vibrio parahaemolyticus in fish homogenates. Bull. Korean Fish. Soc, 19(2), 136~140.
-
Kwon WH, Lee WG, Song JE, Kim KY, Shim WB, Yoon YH, Kim YS and Chung DH(2012). Microbiological hazard analysis on perilla leaf farms at the harvesting stage for the application of the good agricultural practices (GAP). J. Food Hyg. Saf., 27(3), 295~300.
[https://doi.org/10.13103/JFHS.2012.27.3.295]

-
Lee CY, Sung DE and Oh SS(2012). Profiling and priority selection of foodborne pathogens in fresh produce. J. Food Hyg. Saf.. 27(4), 356~365.
[https://doi.org/10.13103/jfhs.2012.27.4.356]

-
Lee HR, Bae YJ, Son SA, Sohn SK, Lee JB, Kwon GY, Park SH and Shim KB(2024). Comparison of the organic acid content of commercial seasoning Jeotgal and Sikhae. Korean J Fish Aquat Sci, 57(4), 489~496.
[https://doi.org/10.5657/KFAS.2024.0489]

-
Lee JS, Park JM, Kim AJ, Lee JS, Park JM and Kim AJ(2022). The history of salted-seafood consumption and an evaluation of its nutritional and functional value. Asian J Beauty Cosmetol, 20(2), 273~284.
[https://doi.org/10.20402/ajbc.2022.0035]

-
Lee MG, Jeong HJ, Lee SM, Lee HH, Seo EJ, Park JH, Oh GN, Seo SE, Seo JM and Kim AG(2024). Antimicrobial resistance and genetic characterization of pathogenic Campylobacter spp. isolated from distribution poultry in Gwangju metropolitan city. J. Food Hyg. Saf.
[https://doi.org/10.13103/jfhs.2024.39.1.16]

-
Lee SH and Park KS(2023). Toxin genes and antimicrobial resistance of Clostridium perfringens strains isolated from commercial Jeotgals. Korean J Fish Aquat Sci, 56, 826~832.
[https://doi.org/10.5657/KFAS.2023.0826]

- Lee SM, Lim JM, Kim KH, Cho SY, Park KS, Sin YM, Cheung CY, Cho JI, You HJ, Kim KH, Cho DH, Lim CJ and Kim OH(2008). Microbiological study using monitoring of microorganism in salt-fermented fishery products. J. Food Hyg. Saf., 23(3), 198~205.
- Lee, YM(2021). Microbiological quality of ready-to-eat side dish and its processing environment. Master’s thesis, Korea University, Seoul, South Korea.
- MFDS(2024). Ministry of Food and Drug Safety. Retrieved from https://various.foodsafetykorea.go.kr/fsd/#/ext/Document/FC
- Moon, JH(2009). A quantitative microbial risk assessment model for salt effects on the inhibiting Salmonella enteritidis. doctoral disseration, Hanyang University, Seoul, South Korea.
-
Park HJ and Bae HJ(2007). Hazard analysis of Staphylococcus aureus in ready-to-eat sandwiches. J Korean Soc Food Sci Nutr, 36(7), 938~943.
[https://doi.org/10.3746/jkfn.2007.36.7.938]

-
Shin HS, Chung KH, Yun SM and Lee SH(2009). Climate Change, Food-borne disease prediction, and future impact. KIHASA, 29(1), 123~138.
[https://doi.org/10.15709/hswr.2009.29.1.123]

-
Skanavis C and Yanko WA(2001). Clostridium perfringens as a potential indicator for the presence of sewage solids in marine sediments. Mar. Pollut. Bull., 42(1), 31~35.
[https://doi.org/10.1016/S0025-326X(00)00087-4]

- Solberg M, Buckalew JJ, Chen CM, Schaffner DW, O’Neill K, Mcdowell J, Post LS and Boderck M(1990). Microbiological safety assurance system for food service facilities. Food Technol., 44, 68~73.
-
Song MG, Kim SH, Kim JS., Lee JS, Heu MS and Park SY(2022). Risk analysis and safety assessment of microbiological and chemical hazards in Katsuobushi products distributed in the market. Korean J Fish Aquat Sci, 55(4), 431~436.
[https://doi.org/10.5657/KFAS.2022.0431]

-
Um JY, Jang HJ, Choi YJ, Kim SY, Jo A, Kim MY, Ahn JH and Kim JD(2023). Prevalence of microbiological contamination in the ready-to-eat side dishes sold in Gyeongsangnam-do, South Korea. J. Food Hyg. Saf., 38(4), 217~227.
[https://doi.org/10.13103/JFHS.2023.38.4.217]

-
Vondrakova L, Pazlarova J, and Demnerova K(2014). Detection, identification and quantification of Campylobacter jejuni, coli and lari in food matrices all at once using multiplex qPCR. Gut pathogens, 6, 1~9.
[https://doi.org/10.1186/1757-4749-6-12]
