사육밀도가 강도다리(Platichthys stellatus) 치어의 성장, 사료이용성 및 체조성에 미치는 영향
Abstract
This study evaluated the effects of stocking density on growth, feed utilization and body composition of juvenile starry flounder (Platichthys stellatus). Starry flounder juvenile were reared at five stocking densities [ratio of body surface area to tank bottom area: 3, 2, 1, 1/2 and 1/3]. At the end of 80 days feeding trial, survival of juvenile starry flounder reared at various density conditions was ≥ 89% and there was no significant difference among all experimental groups. Weight gain of fish at the 3 group was significantly lower than that of fish at the 1 group. Specific growth rate of fish at the 3 groups was significantly lower than that of fish at the 1/3, 1/2 and 1 groups, but not significantly differ from that of fish at the 2 group. Feed consumption of fish at the 1/3 group was significantly lower than that of fish at the 2 and 3 groups, whereas the 1/2 and 1 groups were not showed significantly different. Feed efficiency of fish at the 1 group was significantly higher than that of fish at the 2 and 3 groups, but not significantly differ from that of fish at the 1/3 and 1/2 groups. Hepatosomatic index of fish at the 1/3 group was significantly higher than that of fish at the 2 and 3 groups, whereas the 1/2 and 1 groups were not showed significantly different. Based on these results, the optimum stocking density for juvenile starry flounder (6.7 g/fish) is a ratio of body surface area to bottom area tank of 1.
Keywords:
Stocking density, Growth, Feed utilization, Body composition, Starry flounderⅠ. 서 론
양식 어류의 성장과 생리적 기능은 다양한 환경적 요인에 의해 영향을 받으며(Imsland et al., 2017; Refaey et al., 2018), 그 중 사육밀도는 중요한 환경요인으로서 양식어의 성장과 건강도에 영향을 미치는 것으로 알려져 있다(Costa et al., 2017). 사육밀도는 먹이경쟁 및 공간경쟁을 유발하여 대상어의 성장에 영향을 미쳐 다양한 어종을 대상으로 한 연구가 수행된 바 있다(Brett, 1979). 높은 사육밀도는 치어기 터봇(Scophthalmus maximus)(Jia et al., 2016), channel catfish (Ictalurus punctatus) (Refaey et al., 2018) 및 철갑상어(Acipenser sinensis) (Long et al., 2019) 등의 성장에 부정적인 영향을 미치는 것으로 나타났으며, 치어기 mulloway (Argyrosomus japonicus) (Pirozzi et al., 2009) 및 meagre (Argyrosomus regius) (Millán-Cubillo et al., 2016)와 같은 일부 어종에 있어 성장에 긍정적인 영향을 미치는 것으로 보고된 바 있다. 이처럼 어종에 따라 사육밀도가 미치는 영향에는 차이가 있으므로, 대상어종에 맞는 적정 사육밀도를 찾는 연구가 필요하다.
강도다리(Platichthys stellatus)는 가자미목(Pleuronectiformes), 가자미과(Pleuronectidae)에 속하는 어류로 우리나라 동해 중부의 이북에 주로 분포하며, 일본 북부, 오호츠크해, 베링해, 알래스카만에서 캘리포니아만에 이르기까지 광범위하게 분포한다(NFRDI, 2019). 주로 초겨울부터 이듬해 봄(11월~4월)에 걸쳐 어획되고 있으며, 넙치에 비해 육질의 강도(texture)가 약 1.7배 높고, 고도불포화지방산(highly unsaturated fatty acid)인 EPA(eicosapentaenoic acid) 함량은 1.6배나 높아 소비자들이 선호하는 어종이다(NFRDI, 2019). 이러한 수요 증가로 2018-2020년 국내 강도다리 양식생산량은 2014년 2,377톤에서 2022년 7,723톤으로 대폭 증가하여(KOSIS, 2023), 강도다리 양식생산 기술과 관련한 사료영양, 사육환경, 질병 등의 다양한 연구가 수행된 바 있으나(Ding et al., 2010; Kim et al., 2021; Shin and Lee, 2023), 사육밀도에 관한 연구는 미비한 실정이다.
따라서 본 연구에서는 사육밀도에 따른 강도다리 치어의 성장, 사료이용성 및 체조성에 미치는 영향을 조사하였다.
II. 연구 방법
1. 실험어 및 사육 조건
실험어는 국립수산과학원에서 종묘생산한 치어를 이용하였으며, 사육개시 전 사육환경에 적응시키기 위해 2주간 평균 수온 15.1 ± 0.15℃의 2톤 유수식 FRP 원형 수조(지름 1.6 m, 수심 1 m)에서 순치하였고 충분한 양의 시판용 침강사료(천하제일사료; 수분 6.5%, 조단백질 52.1%, 조지질 11.0%, 조회분 14.8%)를 1일 2회 공급하였다. 사육실험 개시 전 평균 6.7 ± 1.9 g의 강도다리 치어(전장: 67.0 ± 5.9 mm)를 24시간 절식한 후 저면적 0.6 m2의 원형 FRP 수조(지름 90 cm, 수심 50 cm)에 각각 체표면적의 비를 3, 2, 1, 1/2 및 1/3으로 설정하여, 각각 876, 584, 292, 145 및 97마리를 2반복으로 10개의 사육수조에 무작위로 수용하였으며, 이때 체표면적은 방안지법을 이용하여 측정하였다. 80일간의 사육실험 기간 동안 매일 YSI58 (YSI Incorporated, USA)을 이용하여 수온, 염도 및 용존산소를 측정하였고, 각각 15.1 ± 2.3℃, 32.7 ± 0.5 psu 및 6.36 ± 0.4 mg/L 이었으며, 광주기는 자동타이머를 이용하여 12시간 명기(07:00-19:00) 조건을 두었다. 실험개시 후 실험어는 시판용 침강사료(천하제일사료)를 이용하여 1일 3회(09:00, 13:00 및 17:00) 만복 수준으로 공급하였다.
2. 어체 측정
어체 측정을 위해 모든 실험어는 사육실험 종료시 24시간 절식한 후 100 ppm의 tricaine methanesulfonate (MS-222; Sigma-Aldrich, St. Louis, MI, USA)로 마취시켜 각 수조의 최종 무게 및 생존한 개체 수를 측정하여, 생존율(survival), 어체중증가(weight gain), 일일성장률(specific growth rate) 및 사료효율(feed efficiency)을 계산하였다. 이후 수조당 무작위로 30마리를 선택하여 각 전어체 무게를 측정한 후, 간중량지수(hepatosomatic index, HSI) 및 내장중량지수(viscerosomatic index, VSI)를 계산하기 위해 간과 내장을 채취하여 무게를 측정하였다.
- 간중량지수(hepatosomatic index, HSI): (간중량/어체중) × 100
- 내장중량지수(viscerosomatic index, VSI): (내장중량/어체중) × 100
3. 일반성분분석
전어체의 일반성분분석을 위해 각 실험수조에서 5마리씩 샘플하였고, 일반성분분석은 AOAC(2005) 표준분석방법에 따라 수분, 조단백질, 조지질 및 회분함량을 분석하였으며, 수분은 105℃ dry oven에서 24시간 동안 건조한 후 측정하였다. 조단백질은 Auto Kjeldahl System (Buchi B-324/435/ 412, Switzerland)을 사용하여 분석하였고, 조지질은 에테르 추출법(ST 243 SoxtecTM; FOSS, Hillerod, Denmark)을 이용하여 분석하였으며, 회분은 550℃ 회화로에서 4시간 동안 태운 후 정량하였다.
4. 통계 분석
모든 데이터는 SPSS version 27.0 (SPSS Michigan Avenue, Chicago, IL, USA)을 이용하여 One-way ANOVA와 Duncan’s multiple range test (Duncan, 1955)로서 각 실험구간의 유의성(P<0.05)을 검증하였다.
Ⅲ. 연구 결과
1. 성장 및 사료이용성
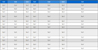
각각의 사육밀도 조건(1/3, 1/2, 1, 2 및 3)에서 80일간의 사육실험 종료시 강도다리 치어의 성장 및 사료이용성 결과는 (<Table 1>)에 나타내었다. 사육실험 종료시 생존율은 모든 실험구에서 89.0±0.57% 이상으로, 실험구간의 유의적인 차이는 나타나지 않았다(P>0.05). 그러나 최종 무게(g/fish) 및 어체중증가(g/fish)는 1 실험구가 3 실험구에 비하여 유의적으로 높게 나타났으나(P<0.05), 1/3, 1/2 및 2 실험구와는 유의적인 차이가 나타나지 않았다(P>0.05). 일일성장률(%/day)은 3 실험구가 1/3, 1/2 및 1 실험구에 비하여 유의적으로 낮게 나타났으나(P<0.05), 2 실험구와는 유의적인 차이가 나타나지 않았다(P>0.05). 사료섭취량(g/fish)은 2 실험구가 1/3, 1/2 및 1 실험구에 비하여 유의적으로 높게 나타났고(P<0.05), 3 실험구와는 유의적인 차이가 나타나지 않았다(P>0.05). 사료효율은 1/3, 1/2 및 1 실험구가 2 및 3 실험구에 비하여 유의적으로 높게 나타났다(P<0.05). VSI는 실험구간의 유의적인 차이가 나타나지 않았고(P>0.05), HSI는 1/3 실험구가 2 및 3 실험구에 비하여 유의적으로 높게 나타났으나(P<0.05), 1/2 및 1 실험구와는 유의적인 차이가 나타나지 않았다(P>0.05).
Ⅳ. 결 론
어류 성장에 관여하는 요인으로는 유전적 요인, 내적 요인(성장호르몬, 및 인슐린 등), 외적 요인(수온, 염분, 수질 및 용존산소량) 및 생물학적 요인(사료 및 사육밀도)이 있다(Choi et al., 2002). 그 중 사육밀도는 환경적 스트레스 요인으로 어류의 성장에 영향을 미치는 것으로 알려져 있다(Long et al., 2019). 또한 사육밀도는 개체들 간의 먹이 및 공간에 대한 경쟁을 유도하여 사료섭취량에 영향을 미쳐 양식어류의 성장, 건강, 양식생산성 등에 영향을 미친다(Refstie, 1977; Brett, 1979; Rowland et al., 2006; Kim et al., 2015). 본 연구에서 최종 무게(g/fish) 및 어체중증가(g/fish)는 3 실험구가 1 실험구에 비하여 유의적으로 낮게 나타났다(P<0.05). 본 연구와 유사하게 치어기 넙치(Paralichthys olivaceus) (Duan et al., 2011)와 치어기 터봇(Jia et al., 2016)에 있어서도 사육밀도의 증가에 따라 성장에 부정적인 영향을 미치는 것으로 나타났다. Lupatsch et al.(2010)에 따르면 만성 밀식 스트레스는 치어기 어류의 성장에 부정적인 영향을 주며, 환경 스트레스가 어류의 에너지 수요를 증가시켜 어류의 스트레스에 대처하기 위해 대사 에너지의 증가로 성장 에너지의 상대적 감소에서 기인한 것으로 보고하였다. 또한, 본 연구에서 사육밀도가 증가함에 따라 사료섭취량이 증가하였으며, 이는 사육밀도가 증가함에 따라 넙치의 사료섭취량은 증가하지만, 성장은 감소하는 결과(Kim et al., 2015)와 유사하게 나타났다. 이와 더불어 본 연구에서 사료효율은 사육밀도가 증가함에 따라 감소하였는데 이는 대서양 연어(Salmo salar) (Liu et al., 2014)와 golden pompano (Trachinotus ovatus) (Yang et al., 2020)의 연구 결과와 유사하게 나타났으며, 이는 어류가 더 높은 밀도의 스트레스에 대처하기 위해 더 많은 에너지를 필요로 하므로 동일한 성장을 달성하기 위해 사육밀도가 높은 그룹의 어류가 더 많은 사료를 섭취해야 함을 시사하는 것으로 판단된다. 그러나 이와 달리 치어기 터봇과 유럽 농어(Dicentrarchus labrax)에서는 사육밀도가 사료이용성에 영향을 미치지 않는 것으로 나타났다(Aksungur et al., 2007; Sammouth et al., 2009). 이처럼 본 연구와 이전 연구 결과들의 차이는 어종, 성장단계, 영양상태, 사료의 형태 및 조성, 수온 등의 차이 때문인 것으로 판단된다. 본 연구에서 HSI는 1/3 실험구가 2 및 3 실험구에 비하여 유의적으로 높게 나타났으나(P<0.05), 1/2 및 1 실험구와는 유의적인 차이가 나타나지 않았다(P>0.05). 간은 대사의 중심 기관으로 작용하며, 특히 간 대사는 스트레스 적응에 있어서 중요한 역할한다(Wiseman et al., 2007). 이와 더불어, 간의 대사과정과 에너지 보유량은 HSI와 밀접한 관련이 있으며, 이 관련성은 어류의 대사, 영양 상태, 그리고 성장률과 연관되어있다(Pyle et al., 2005; Luckenbach et al., 2007; Kumar et al., 2017). Leatherland and Cho(1985)에 따르면 사육밀도의 증가에 따른 HSI의 감소는 사육밀도 증가가 스트레스로 작용하여 대사과정이 활성화되어 체내의 지질 이동량의 증가에 의한 것으로 보고하였다. 이와 유사하게 본 연구에서도 사육밀도가 증가함에 따라 강도다리 치어의 HSI가 감소하는 것으로 나타났으나, 이후 사육밀도에 따른 간 조직의 영양학적, 생리학적 분석 및 혈액성상(지질 구성) 등의 분석을 통해 사육밀도에 따른 영양소 대사과정에 대한 연구가 필요할 것으로 판단된다. 이와 달리 VSI는 사육밀도에 영향을 받지 않은 것으로 나타났다(P>0.05). 본 연구 결과와 유사하게 몇몇 연구에서도 사육밀도에 따라 실험어의 VSI에 영향을 미치지 않았다(Qi et al., 2016; Diogenes et al., 2019; Chen et al., 2021).
본 연구에서 전어체의 수분, 조단백질, 조지질 및 회분함량은 사육밀도에 따른 유의한 영향을 받지 않는 것으로 나타났다(P>0.05). 본 연구결과와 유사하게 사육밀도에 따라 날쌔기(Rachycentron canadum)의 체조성은 유의한 영향을 보이지 않는 것으로 나타났고(Riche et al., 2013), 쏘가리(Siniperca scherzeri)는 사육밀도에 따라 어체의 수분, 단백질 및 지질 함량은 영향을 받지 않았으나, 회분 함량은 유의한 영향을 받는 것으로 나타났다(Lee and Kim, 2017). 또한, Moniruzzaman et al. (2015)의 연구에서 나일틸라피아(Oreochromis niloticus L.) 전어체의 지질 함량은 사육밀도에 따라 유의한 영향을 받는 것으로 나타났고, lridescent shark (Pangasianodon hypophthalmus) 어체의 수분, 단백질, 지질 및 회분함량도 유의한 영향을 받았다(Zaki et al., 2023). Gangetic mystus catfish (Mystus cavasius)는 사육밀도에 따라 어체의 수분 및 회분함량은 영향을 받지 않았으나, 단백질 및 지질함량은 사육밀도가 증가함에 따라 유의한 영향을 받았다는 연구 결과도 보고된 바 있다(Jewel et al., 2023). Liu et al.(2014)에 따르면 사육밀도에 따른 대서양 연어 어체의 수분, 지질 및 회분함량은 영향을 받지 않았으나, 단백질함량은 유의한 영향을 받는 것으로 보고했다. 그러나 Toko et al.(2007)은 체조성이 사육 조건에 따라 직접적으로 영향을 받을 수 있지만, 동시에 대상 어류의 성장률과 같은 생리적 차이로 인해 간접적으로 영향을 받을 수 있다고 보고하였다. 따라서 사육밀도에 따른 강도다리의 조직별 생화학적 성분 분석을 통해 사육밀도가 강도다리의 영양대사에 미치는 영향에 관한 연구가 수행되어야 한다.
이상의 결과를 고려하면 강도다리 치어(6.7 g)에 있어 사육밀도는 수조 저면적(0.6 m2)에 대한 체표면적의 비 1이 성장과 사료효율 측면에 있어 적절한 것으로 판단된다. 본 연구 결과는 강도다리 양식산업 현장에서 실용적인 정보로 활용될 것으로 기대되며, 앞으로는 다양한 사육밀도에 따른 영양 및 생리학적 연구가 추가 수행될 필요가 있다.
Acknowledgments
이 논문은 2023년도 해양수산부 국립수산과학원 수산시험연구사업 주요 양식품종 모니터링(R2023045)의 지원으로 수행된 연구입니다.
References
- Aksungur N, Aksungur M, Akbulut B and Kutlu I(2007). Effects of stocking density on growth performance, survival and food conversion ratio of Turbot (Psetta maxima) in the net cages on the southeastern coast of the Black Sea. Turk J Fish Aquat Sci, 7(2).
- Brett JR(1979). Environmental factors and growth. Fish physiology, 8, 599~675.
-
Chen L, Yang YO, Rizwan M, Yue DD, Khan IM, Yao F and Huang SJ(2021). Compensatory growth in gibel carp (carassius auratus gibelio) after the stress of stocking density. Aquac Res, 52(4), 1697~1704.
[https://doi.org/10.1111/are.15022]

- Choi YU, Rho S and Lee YD(2002). Effect of water temperature and stocking density on growth of juvenile red drum Sciaenops ocellatus. J Aquac, 15(3), 131~138.
- Costa AAP, Roubach R, Dallago BSL, Bueno GW, McManus C and Bernal FEM(2017). Influence of stocking density on growth performance and welfare of juvenile tilapia (Oreochromis niloticus) in cages. Arq Bras Med Vet Zootec, 2, 43~251. http://hdl.handle.net/11449/162609
-
Ding L, Zhang L, Wang J, Ma J, Meng X, Duan P and Sun Y(2010). Effect of dietary lipid level on the growth performance, feed utilization, body composition and blood chemistry of juveniles starry flounder (Platichthys stellatus). Aquac Res, 41(10), 1470~1478.
[https://doi.org/10.1111/j.1365-2109.2009.02440.x]

-
Diogenes AF, Teixeira C, Almeida E, Skrzynskaaaa A, Costas B, Oliva-Teles A and Peres H(2019). Effects of dietary tryptophan and chronic stress in gilthead seabream (Sparus aurata) juveniles fed corn distillers dried grains with solubles (DDGS) based diets. Aquaculture, 498, 396~404.
[https://doi.org/10.1016/j.aquaculture.2018.08.079]

-
Duan Y, Dong X, Zhang X and Miao Z(2011). Effects of dissolved oxygen concentration and stocking density on the growth, energy budget and body composition of juvenile Japanese flounder, Paralichthys olivaceus (Temminck et Schlegel). Aquac Res, 42(3), 407~416.
[https://doi.org/10.1111/j.1365-2109.2010.02635.x]

-
Imsland AKD, Roth B, Fjelldal PG, Stefansson SO, Handeland S and Mikalsen B(2017). The effect of continuous light at low temperature on growth in Atlantic salmon reared in commercial size sea pens. Aquaculture, 479, 645~651.
[https://doi.org/10.1016/j.aquaculture.2017.07.014]

-
Jewel MAS, Ara J, Haque MA, Hossain MA, Noor NM and Das SK(2023). Effect of stocking density on the growth, body composition, and blood parameters of cage-reared Gangetic mystus catfish (Mystus cavasius). Aquac Rep, 28, 101428.
[https://doi.org/10.1016/j.aqrep.2022.101428]

-
Jia R, Liu BL, Feng WR, Han C Huang B and Lei JL(2016). Stress and immune responses in skin of turbot (Scophthalmus maximus) under different stocking densities. Fish Shellfish Immunol, 55, 131~139.
[https://doi.org/10.1016/j.fsi.2016.05.032]

-
Jia R, Liu BL, Han C, Huang B and Lei JL(2016). Influence of Stocking Density on Growth Performance, Antioxidant Status, and Physiological Response of Juvenile Turbot, Scophthalmus Maximu, Reared in Land-Based Recirculating Aquaculture System. J World Aquac Soc, 47(4), 587~599.
[https://doi.org/10.1111/jwas.12295]

-
Kim SS, Han GS, Yoo HK, Kim KT, Byun SG, Jung MM and Hwang SD(2021). Effect of temperature fluctuation and nutritional status on starry flounder, Platichthys stellatus, survival and adaptive physiological response. J Mar Sci Eng, 9(12), 1361.
[https://doi.org/10.3390/jmse9121361]

- Kim SS, Lee JH, Kim KW, Kim KD, Lee BJ and Lee KJ(2015). Effects of feed particle size, stocking density, and dissolved oxygen concentration on the growth of Olive flounder Paralichthys olivaceus. Kor J Fish Aquatic Sci, 48(3), 314~321.
-
Kumar N, Krishnani KK, Meena KK, Gupta SK and Singh NP(2017). Oxidative and cellular metabolic stress of Oreochromis mossambicus as biomarkers indicators of trace element contaminants. Chemosphere, 171, 265~274.
[https://doi.org/10.1016/j.chemosphere.2016.12.066]

-
Leatherland JF and Cho CY(1985). Effect of rearing density on thyroid and interrenal gland activity and plasma hepatic metabolite levels in rainbow trout, Salmo gairdneri, Richardson. J Fish Biol, 27(5), 583~592.
[https://doi.org/10.1111/j.1095-8649.1985.tb03203.x]

-
Lee K-W, Han G-S, Lim H-J and Byun S-G(2021). Influence of Water Temperature on Growth of Juvenile Starry flounder (Platichthys stellatus). The Journal of the Korean Society for Fisheries and Marine Sciences Education 33, 515~524.
[https://doi.org/10.13000/JFMSE.2021.4.33.2.515]

- Lee SM and Kim YO(2017). Effect of stocking density on the growth and body composition of the mandarin fish Siniperca scherzeri. Kor J Fish Aquatic Sci, 50(6), 762~769.
- Liu B, Liu Y, Liu Z, Qiu D, Sun G and Li X(2014). Influence of stocking density on growth, body composition and energy budget of Atlantic salmon Salmo salar L. in recirculating aquaculture systems. Chin J Oceanl Limnol, 32(5), 982~990.
-
Long L, Zhang H, Ni Q, Liu H, Wu F and Wang X(2019). Effects of stocking density on growth, stress, and immune responses of juvenile Chinese sturgeon (Acipenser sinensis) in a recirculating aquaculture system. Comp Biochem Physiol C Toxicol Pharmacol, 219, 25~34.
[https://doi.org/10.1016/j.cbpc.2019.02.002]

-
Luckenbach JA, Murashige R, Daniels HV, Godwin J and Borski RJ(2007). Temperature affects insulin-like growth factor I and growth of juvenile southern flounder, Paralichthys lethostigma. Comp Biochem Physiol A, 146(1), 95~104.
[https://doi.org/10.1016/j.cbpa.2006.09.024]

-
Lupatsch I, Santos GA, Schrama JW and Verreth JAJ(2010). Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bass Dicentrarchus labrax. Aquaculture, 298(3-4), 245~250.
[https://doi.org/10.1016/j.aquaculture.2009.11.007]

-
Millán-Cubillo AF, Martos-Sitcha JA, Ruiz-Jarabo I, Cardenas S and Mancera JM(2016). Low stocking density negatively affects growth, metabolism and stress pathways in juvenile specimens of meagre (Argyrosomus regius, Asso 1801). Aquaculture, 451, 87~92.
[https://doi.org/10.1016/j.aquaculture.2015.08.034]

-
Moniruzzaman M, Uddin KB, Basak S, Mahmud Y, Zaher M and Bai SC(2015). Effects of stocking density on growth, body composition, yield and economic returns of monosex tilapia (Oreochromis niloticus L.) under cage culture system in Kaptai Lake of Bangladesh. J Aquac Res Dev, 6(8), 1.
[https://doi.org/10.4172/2155-9546.1000357]

- NFRDI (National Fisheries Research and Development Institute)(2019). Technical Manual for the Starry flounder Aquaculture. East Sea Fish Res Inst, Uljin, Korea, 131.
- Pirozzi I, Booth MA and Pankhurst PM(2009). The effect of stocking density and repeated handling on the growth of juvenile mulloway, Argyrosomus japonicus (Temminck and Schlegel 1843). Aquac Int, 17, 199~205.
-
Pyle GG, Rajotte JW and Couture P(2005). Effects of industrial metals on wild fish populations along a metal contamination gradient. Ecotoxicol Environ Saf, 61(3), 287~312.
[https://doi.org/10.1016/j.ecoenv.2004.09.003]

-
Qi C, Xie C, Tang R, Qin X, Wang D and Li D(2016). Effect of stocking density on growth, physiological responses, and body composition of juvenile blunt snout bream, Megalobrama amblycephala. J World Aquac Soc, 47(3), 358~368.
[https://doi.org/10.1111/jwas.12278]

-
Refaey MM, Li D, Tian X, Zhang Z, Zhang X, Li L and Tang R(2018). High stocking density alters growth performance, blood biochemistry, intestinal histology, and muscle quality of channel catfish Ictalurus punctatus. Aquaculture, 492, 73~81.
[https://doi.org/10.1016/j.aquaculture.2018.04.003]

-
Refstie T(1977). Effect of density on growth and survival of rainbow trout. Aquaculture, 11(4), 329~334.
[https://doi.org/10.1016/0044-8486(77)90082-5]

-
Riche MA, Weirich CR, Wills PS and Baptiste RM(2013). Stocking density effects on production characteristics and body composition of market size cobia, Rachycentron canadum, reared in recirculating aquaculture systems. J World Aquac Soc, 44(2), 259~266.
[https://doi.org/10.1111/jwas.12023]

-
Rowland SJ, Mifsud C, Nixon M and Boyd P(2006). Effects of stocking density on the performance of the Australian freshwater silver perch (Bidyanus bidyanus). Aquaculture, 253(1-4), 301~308.
[https://doi.org/10.1016/j.aquaculture.2005.04.049]

-
Sammouth S, d’Orbcastel ER, Gasset E, Lemarie G, Breuill G, Marino G and Blancheton JP(2009). The effect of density on sea bass (Dicentrarchus labrax) performance in a tank-based recirculating system. Aquac Eng, 40(2), 72~78.
[https://doi.org/10.1016/j.aquaeng.2008.11.004]

-
Shin SP and Lee J(2023). Infection of Enteromyxum leei in cultured starry flounder Platichthys stellatus. Fish Aquatic Sci, 26(3), 234~240.
[https://doi.org/10.47853/FAS.2023.e20]

-
Toko I, Fiogbe ED, Koukpode B and Kestemont P(2007). Rearing of African catfish (Clarias gariepinus) and vundu catfish (Heterobranchus longifilis) in traditional fish ponds (whedos): Effect of stocking density on growth, production and body composition. Aquaculture, 262(1), 65~72.
[https://doi.org/10.1016/j.aquaculture.2006.08.054]

-
Wiseman S, Osachoff H, Bassett E, Malhotra J, Bruno J, VanAggelen G, Mommsen TP and Vijayan MM(2007). Gene expression pattern in the liver during recovery from an acute stressor in rainbow trout. Comp Biochem Physiol Part D Genomics Proteomics, 2(3), 234~244.
[https://doi.org/10.1016/j.cbd.2007.04.005]

-
Yang Q, Guo L, Liu BS, Guo HY, Zhu KC, Zhang N and Zhang DC(2020). Effects of stocking density on the growth performance, serum biochemistry, muscle composition and HSP70 gene expression of juvenile golden pompano Trachinotus ovatus (Linnaeus, 1758). Aquaculture, 518, 734841.
[https://doi.org/10.1016/j.aquaculture.2019.734841]

-
Zaki MA, Khalil HS, Allam BW, Khalil RH, Basuini MFE, Nour AEAM and Abdel-Latif HM(2023). Assessment of zootechnical parameters, intestinal digestive enzymes, haemato-immune responses, and hepatic antioxidant status of Pangasianodon hypophthalmus fingerlings reared under different stocking densities. Aquac Int, 1~24.
[https://doi.org/10.1007/s10499-023-01092-w]